*仅供医学专业人士阅读参考
帕金森病已成为世界上第二大神经退行性疾病,并且患病率在未来30年内将会翻一番。患病人数的激增,将给各国的卫生体系带来巨大挑战。
近年来,得益于基因检测技术、影像学技术、人工智能等技术的迅猛发展,帕金森病诊断性生物标志物的开发,已经取得了实质性的进展[1]。
由于帕金森病病理机制不明确性,目前临床上仍没有延缓神经退行性变过程的治疗方法[2]。因此,开发出一种能够减缓帕金森病神经退行性变过程的治疗手段,成为了一道摆在各国研究人员面前的难题。
近日,由美国拉什大学医学中心Kalipada Pahan领衔的研究团队,在《细胞报告》杂志上发表了一项重要研究成果。
他们首次发现了规律的跑步训练,可以延缓帕金森病小鼠模型的病理进展和运动表现[3]。
具体来说,他们发现规律的跑步训练能够延缓α-突触核蛋白(α-Syn)在小鼠大脑中的扩散,并保护黑质多巴胺能神经元。
论文首页截图
在正常的大脑中,α-Syn对囊泡转运和多巴胺递质的功能发挥着不可或缺的作用,但α-Syn发挥此生理功能的前提是其数量和功能处于正常状态。一旦α-Syn过表达和/或发生突变,α-Syn逐渐形成病理化的寡聚态。
随着病理性的α-Syn在黑质、纹状体等脑区不断扩散、积累,相应区域的神经细胞就会不堪重负死亡,神经功能出现异常,最终发展成帕金森病[4]。而在此之前,并无相应的治疗手段能够有效地阻止α-Syn在大脑中的扩散。因此,一旦患上帕金森病,就会一直处于不断恶化的状态。
众所周知,经常性的锻炼对人类的健康有诸多积极作用。跑步是最简单易行的锻炼方式,已有大量的研究将跑步训练作为改善神经系统疾病患者运动能力的康复项目之一,以提高运动能力[5]。因此,研究人员将目光聚集到规律跑步训练是否对帕金森病产生积极影响上。
Pahan团队注意到,之前已有的研究表明,在内囊(IC)处注射α-突触核蛋白前体原纤维(PFF)后,α-Syn可向运动皮层、纹状体和黑质(SN)区域进行传播[6]。因此,在实验过程中,研究人员运用脑立体注射技术,在2月龄的A53T小鼠(帕金森病模式小鼠)的内囊位置注射PFF,让α-Syn在A53T小鼠脑内经两个月的自然传播。
随后,研究人员将所有小鼠随机分成两组,一组进行为期两个月的跑步机训练,训练频率为每天30min,每周6天;另一组作为对照组不进行跑步训练。两个月后进行组织学和行为学检测。
跑步训练实验设计
研究人员首先对黑质区域的α-Syn和磷酸化的突触核蛋白(pSyn129)进行免疫组织化学染色。
结果表明,与未进行跑步训练组的A53T小鼠(A53T+PFF NR)相比,进行跑步训练组的A53T组小鼠(A53T+PFF R)黑质区域的不可溶的病理性α-Syn明显降低。并且,黑质区域的pSyn129含量也显著减少。
以上实验结果表明,跑步训练可以抑制α-Syn在A53T小鼠黑质中的病理性传播。
同时,研究人员对黑质区域的多巴胺能神经元和催化多巴胺(DA)生成的酪氨酸羟化酶(TH)进行免疫组织化学染色检测。
染色结果显示,与未进行跑步训练组的A53T小鼠(A53T+PFF NR)相比,跑步训练组的A53T组小鼠(A53T+PFF R)黑质区域的多巴胺能神经元和酪氨酸羟化酶丢失量明显减少。
ADtaxi:回忆「记」程车vol.02——AD早期诊断:听瑞典哥德堡大学神经科学与生理学研究所亨利克·泽特博格教授解读,为什么生物标志物如此重要
接下来,研究人员对多巴胺含量、中间产物和酪氨酸羟化酶的含量进行进一步检测。
结果表明,伴随着多巴胺能神经元的保护,规律跑步训练组的多巴胺、酪氨酸羟化酶及中间产物3,4-二羟基苯乙酸(DOPAC)和高香草酸(HVA)丢失量也明显减少。
随后,研究人员对小鼠的运动能力进行了行为检测。
旷场实验的结果显示,跑步训练组的A53T组小鼠(A53T+PFF R)运动能力明显提高。
旷场实验
以上的实验结果说明,规律的跑步训练对A53T小鼠黑质区域的多巴胺能神经元具有明显的保护作用。
在观察到规律的跑步训练对A53T小鼠脑内α-Syn的病理性传播具有保护作用的现象后,研究人员决定进一步对其中的机制进行探究。
在上述的研究中,Pahan团队发现了运动导致不可溶性的病理性α-Syn含量的减少,他们认为这提示自噬和溶酶体蛋白降解途径可能是跑步训练促进错误折叠蛋白聚集体降解的主要机制之一。
因此,他们查阅大量文献寻找线索。Pahan团队注意到,既往研究表明PPARα蛋白在溶酶体生成和自噬途径发挥重要作用,并且有研究表明跑步训练以后骨骼肌内的PPARα蛋白水平明显升高。
综合以上调研结果,研究人员决定围绕PPARα蛋白展开机制研究。经研究证实,跑步训练组的A53T组(A53T+PFF R)小鼠黑质区域的PPARα蛋白水平确实明显升高。
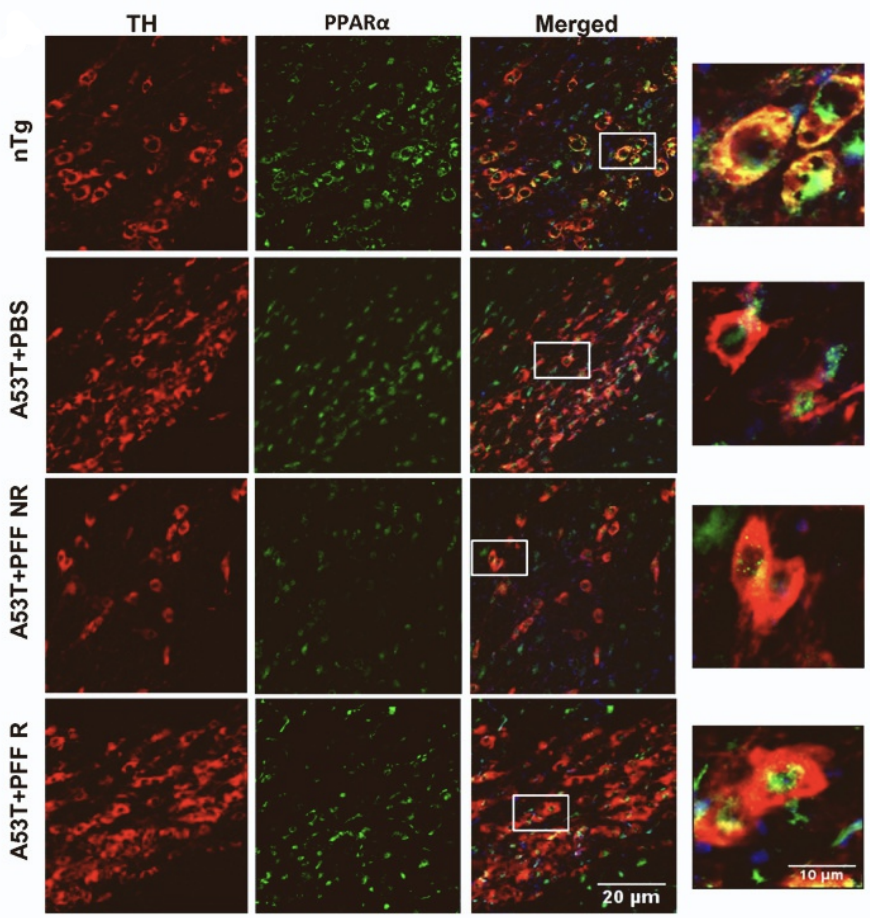
SN区域PPARα免疫荧光染色
接下来研究人员通过将PPARα-/-纯合子小鼠同A53T纯合子小鼠进行杂交获得体内缺乏PPARα蛋白同时过表达α-Syn的子一代小鼠(A53T△PPARα),进一步验证体内缺乏PPARα蛋白后,即使对小鼠进行同样的跑步训练,也无法发挥保护作用。
结果证实,相较于体内PPARα蛋白正常的跑步训练组(A53T+PFF R)小鼠,体内缺乏PPARα蛋白的跑步训练组(A53T△PPARα+PFF R)小鼠黑质区域的pSyn129和不可溶性的病理性α-Syn含量明显升高。
这些结果均提示,PPARα蛋白是跑步训练减缓α-Syn病理性传播的关键。
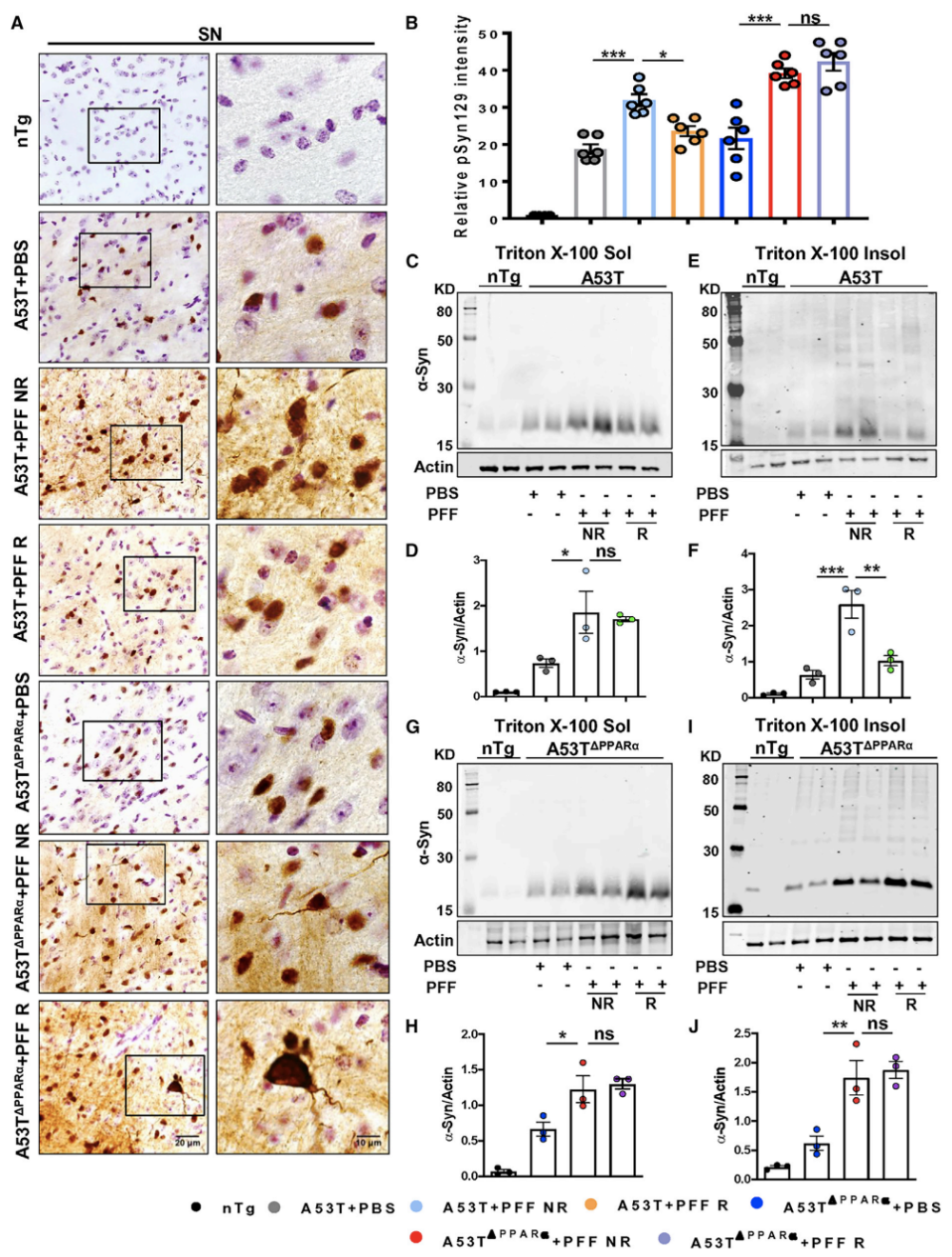
免疫组织化学染色
最后,研究人员尝试让小鼠服用PPARα激动剂Fenofibrate,观察是否能发挥类似跑步训练的保护性作用。
结果证实,Fenofibrate组(A53T + PFF + Feno)小鼠黑质区域的pSyn129和不可溶性的病理性α-Syn含量明显降低,酪氨酸羟化酶神经元和酪氨酸羟化酶丢失量明显减少。
同时,对小鼠进行旷场实验和转棒实验检测,也提示使用Fenofibrate后运动能力得到了改善。
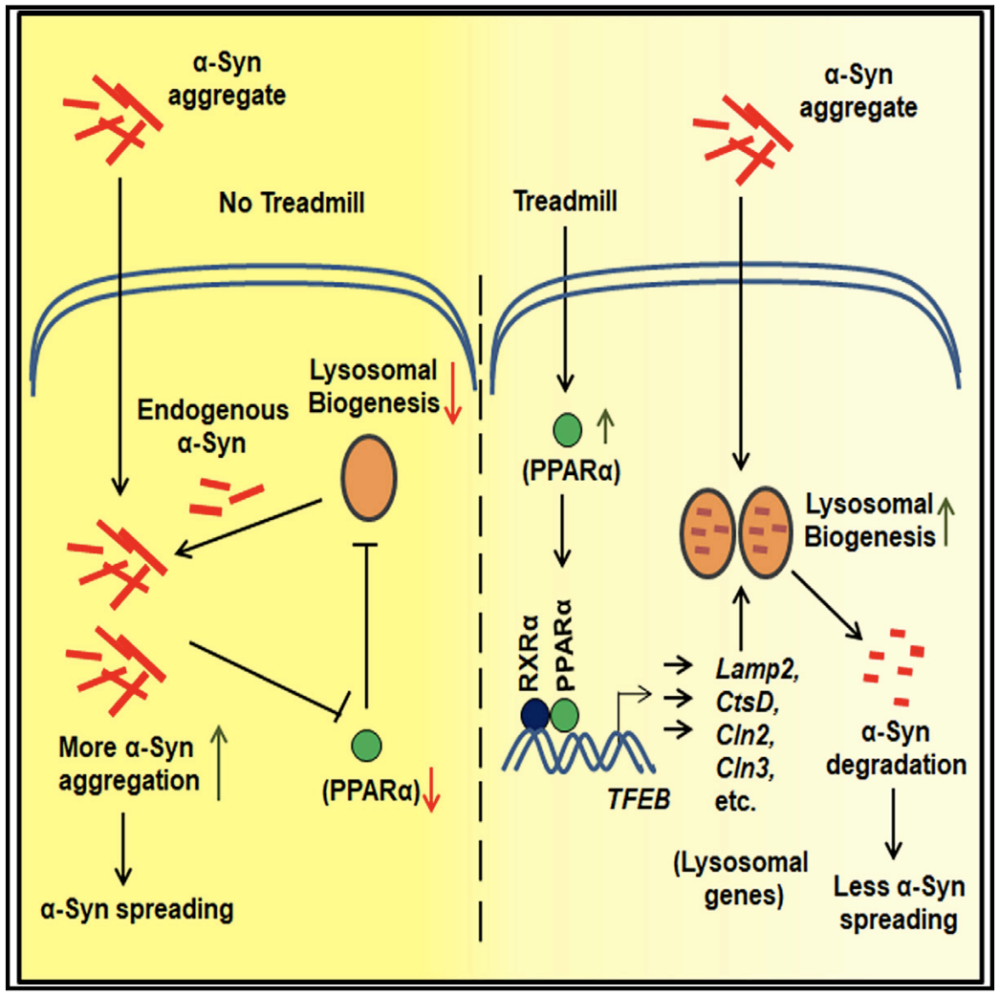
这些结果证实,小鼠使用PPARα激动剂后,能够延缓α-Syn病理性播散并保护酪氨酸羟化酶神经元。
总的来说,跑步训练或药物介导的PPARα激活,可能有助于预防α-Syn病理扩散和相关神经元变性。Pahan团队的这个研究给帕金森病及其他神经退行性病患者延缓病情进展和提高生活质量带来了全新的希望。

参考文献:
[1].Tolosa E, Garrido A, Scholz SW, Poewe W. Challenges in the diagnosis of Parkinson's disease. Lancet Neurol. 2021;20(5):385-397. doi:10.1016/S1474-4422(21)00030-2
[2].Kalia LV, Lang AE. Parkinson's disease. Lancet. 2015;386(9996):896-912. doi:10.1016/S0140-6736(14)61393-3
[3].Dutta D, Paidi RK, Raha S, Roy A, Chandra S, Pahan K. Treadmill exercise reduces α-synuclein spreading via PPARα. Cell Rep. 2022;40(2):111058. doi:10.1016/j.celrep.2022.111058
[5].Minakaki G, Canneva F, Chevessier F, et al. Treadmill exercise intervention improves gait and postural control in alpha-synuclein mouse models without inducing cerebral autophagy. Behav Brain Res. 2019;363:199-215. doi:10.1016/j.bbr.2018.11.035
责任编辑丨BioTalker




















