*仅供医学专业人士阅读参考
髓母细胞瘤(MB)是儿童最常见的颅内恶性肿瘤。
根据不同的分子特征,其可分为4个亚型:WNT活化型、SHH活化型、Group3型和Group4型[1]。
与成人恶性肿瘤的发生原因不同(环境暴露是非常重要的原因),儿童恶性肿瘤的发生往往是由于遗传所致发育异常[2],而明确肿瘤起源是寻找有效治疗策略的先决条件。
由于MB发生于小脑,因此被认为是源于小脑发育异常[2]。已有研究表明,WNT活化型MB源于菱形唇(RL)下部细胞基因突变所致WNT信号通路激活;SHH活化型MB则源于小脑颗粒神经元前体细胞基因突变导致SHH信号通路激活[3, 4];而Group3型(约占MB的20%)和Group4型(约占MB的40%)MB的起源和病因仍悬而未决。
近日,《自然》杂志背靠背发表了美国圣犹达儿童研究医院Paul A. Northcott团队[5]和加拿大多伦多儿童医院Michael D. Taylor团队[6]的两篇重磅研究,揭开了Group3型和Group4型MB的起源之谜。
两个团队从不同角度,将MB亚型特有的基因改变和分子特征与人类小脑发育的特征进行比对,证明了人类小脑发育过程中特定细胞群体——RL脑室下区(RLSVZ)祖细胞的分化缺陷,是导致Group3型和Group4型MB的起源细胞。
此外,研究人员还发现了导致RLSVZ祖细胞分化缺陷的关键基因突变,即CBFA复合体相关蛋白(特异性表达于人类发育中的小脑)突变,而在体外实验中恢复CBFA复合体功能后,可促使MB肿瘤细胞分化,表明了其作为治疗靶点的潜力。


论文首页截图
接下来我们就一起来看看这两个研究是如何展开的。
Paul A. Northcott团队首先利用发育中的人类小脑单细胞基因转录图谱,比较了MB亚型肿瘤转录特征与小脑各细胞群体的相似性。
研究发现,Group3型MB转录特征与RL中细胞相似,而Group4型MB转录特征与RL的小脑核神经元/单极刷状细胞(GlutaCN/UBC,两种细胞无法从转录组上区分)相类似。
MB亚组肿瘤转录特征与小脑各细胞群体转录特征比对
随后,他们通过伪时间序列分析,建立小脑RL中谷氨酸能细胞的分化轨迹,并将Group3型和Group4型MB细胞(以下简称G3/4 MB细胞)投射到该发育谱系上。
结果显示,G3/4 MB细胞主要与GlutaCN/UBC细胞的早期发育状态相重叠,而部分Group4型MB细胞与GlutaCN/UBC细胞的中期发育状态相吻合。
细胞发育轨迹分析显示G3/4 MB细胞主要与GlutaCN/UBC细胞的早期发育状态相重叠
这些发现表明,G3/4 MB很可能起源于小脑RL中GlutaCN/UBC细胞谱系的前体细胞。
科学家已经知道,在小脑的发育过程中,RL被血管床分为两部分:RL脑室区(RLVZ)和RLSVZ。
通过比对G3/4 MB与人胎儿小脑组分的转录组特征,Northcott团队发现G3/4 MB更有可能起源于RLSVZ,并以表达UBC细胞标志和光感受器蛋白为特征。
通过对686例MB肿瘤标本的检测,研究人员发现,光感受器蛋白(EYS、GNB3、CRX和RPGRIP1)主要表达于Group3型MB,而UBC细胞标志物(EOMES、BARHL1、DDX31和LMX1A)主要表达于Group4型MB。
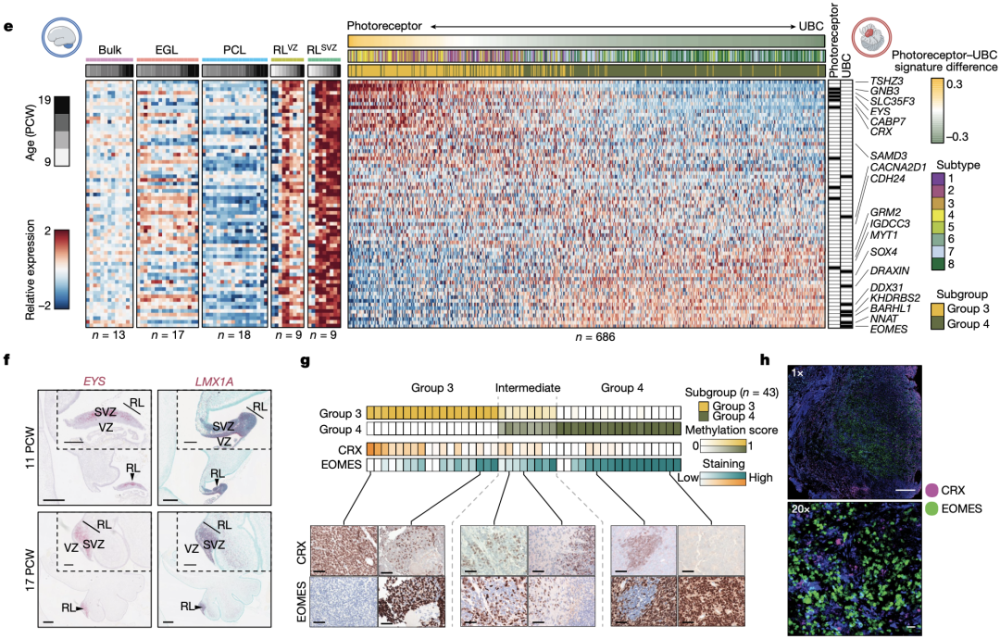
光感受器蛋白主要表达于Group3型MB,而UBC细胞标志物主要表达于Group4型MB
先前的研究已经证实,光感受器的主要转录因子(如NRL、CRX和OTX2)在Group3型MB中高度激活,且这种特征是维持MB细胞系和异种移植瘤生长所必需的[7]。
于是,Northcott团队利用CRISPR–Cas9技术抑制MB细胞中OTX2表达,发现MB细胞神经元分化相关的基因开始出现上调,UBC标志基因也表现为上调,而光感受器相关特征减弱,这表明OTX2在维持MB光感受器蛋白表达特征和抑制谷神经元分化中起着重要作用。
此外,Northcott团队还通过多种测序技术探索了与G3/4 MB相关的突变基因,并发现这些突变特征与人类RLSVZ中的特异性转录模式相匹配。
这些研究表明,RLSVZ细胞类型特异性基因的活性在G3/4 MB发生中起到重要作用。
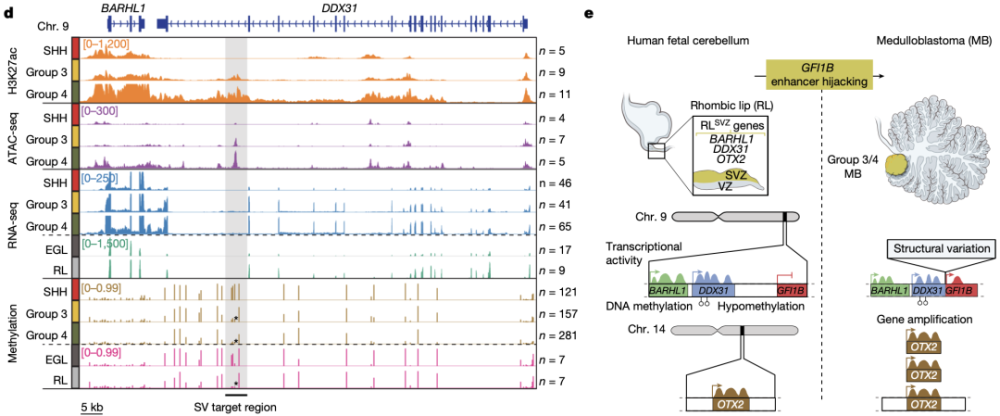
G3/4 MB相关的突变基因特征与人类RLSVZ中的特异性转录模式相匹配
那为啥以前的研究没有发现G3/4 MB是起源于RLSVZ呢?
原来,先前对于MB起源的研究许多都是通过小鼠模型进行研究,而人和小鼠的小脑RL之间存在一定的转录特征差异,如人RLSVZ的光感受器蛋白表达特征在任何类型的小鼠小脑细胞中都未发现。
因此,这种物种之间的差异可能是导致先前的研究没能明确G3/4 MB起源的原因。
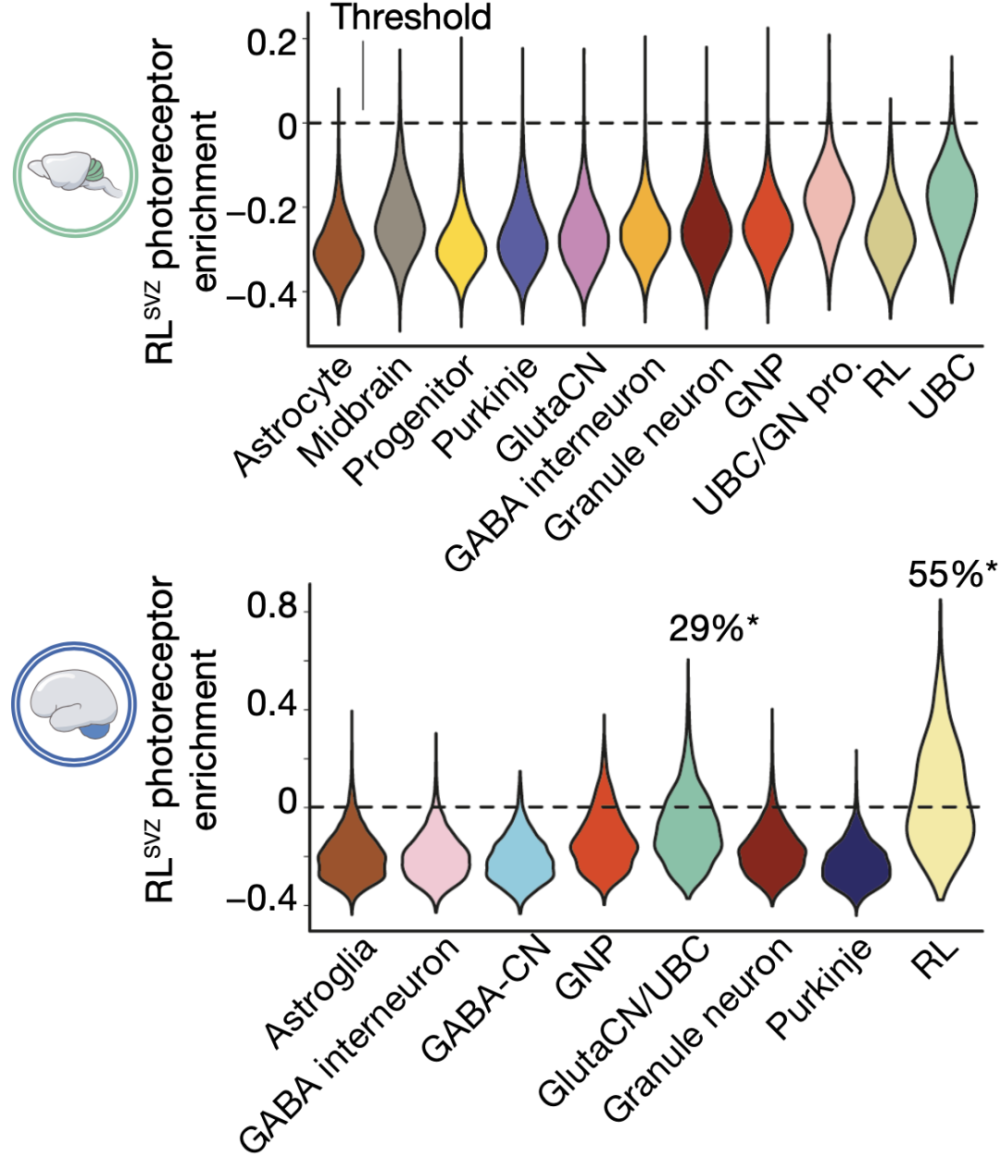
人和小鼠的RL之间存在一定的转录特征差异
说完Northcott团队的研究,咱们再来看看Taylor团队的研究,Taylor团队是从研究G3/4 MB肿瘤的基因突变开始。
Taylor团队在编码CBFA复合体成员或与CBFA复合体相互作用蛋白的基因中,发现了经常出现的会使CBFA复合体功能异常的基因突变(在至少57%的Group4型MB和39%的Group3型MB中发现了破坏CBFA复合体功能的突变),如CBFA2T2和CBFA2T3突变。

G3/4 MB肿瘤经常出现会使CBFA复合体功能异常的基因突变
之前的研究表明CBFA复合体是一种蛋白复合体,可招募具有表观遗传修饰作用的蛋白,起到表观遗传调控作用,从而调节细胞分化[8]。
此外,大多先前报道的G3/4 MB肿瘤的驱动基因均与导致CBFA复合体功能异常的突变相关,如CBFA2T2与KDM6A(KDM6A是已知的Group4型MB的驱动基因)。
这些结果表明CBFA复合体相关基因的突变是G3/4 MB肿瘤发生的重要原因。
紧接着,通过研究CBFA复合体相关蛋白在人类小脑发育过程中的表达特征,Taylor团队发现CBFA2T2在孕11周开始的RLSVZ中特异表达,在孕14-17周时,CBFA2T2和CBFA2T3在RLSVZ中持续表达,且在RLVZ中不表达。
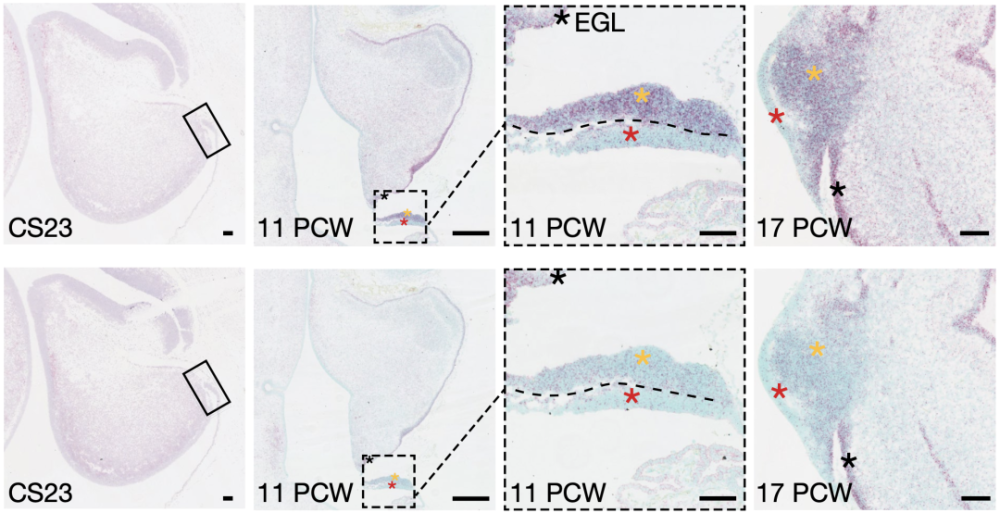
CBFA2T2和CBFA2T3在人类小脑发育过程中的表达
同时,人类小脑RLSVZ和G3/4 MB肿瘤的单核RNA测序结果显示了两者转录特征的相似性,且与RLSVZ中的UBC细胞最为相似,高度提示G3/4 MB可能就是起源于RLSVZ中的UBC前体细胞,并由UBC前体细胞中CBFA复合体功能异常而驱动。
在体外研究中,通过抑制OTX2的表达,可显著增加CBFA2T2和CBFA2T3的表达,使肿瘤细胞恢复分化能力。这再次证明了CBFA复合体功能异常是导致G3/4 MB肿瘤发生的原因。
总的来说,两个团队的研究结果相似且互补,综合两项研究,G3/4 MB肿瘤的起源问题已基本明确,即源于小脑RLSVZ中的UBC前体细胞,且UBC细胞中CBFA复合体功能异常导致的分化功能障碍,则是驱动G3/4 MB肿瘤的“罪魁祸首”。

G3/4 MB起源示意图
了解了肿瘤的起源后,更重要的是从中找到预防和治疗肿瘤的方法,从这两项研究中,或可针对CBFA复合体相关蛋白突变或光感受器基因表达水平异常升高,开发出相关药物,促进肿瘤的分化从而达到治疗肿瘤的目的,这也将成为今后MB药物研发的新热点。

参考文献
1.Hovestadt V, Ayrault O, Swartling FJ, Robinson GW, Pfister SM, Northcott PA: Medulloblastomics revisited: biological and clinical insights from thousands of patients. Nat Rev Cancer 2020, 20(1):42-56.
2.Jones DTW, Banito A, Grunewald TGP, Haber M, Jager N, Kool M, Milde T, Molenaar JJ, Nabbi A, Pugh TJ et al: Molecular characteristics and therapeutic vulnerabilities across paediatric solid tumours. Nat Rev Cancer 2019, 19(8):420-438.
3.Yang ZJ, Ellis T, Markant SL, Read TA, Kessler JD, Bourboulas M, Schuller U, Machold R, Fishell G, Rowitch DH et al: Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells. Cancer Cell 2008, 14(2):135-145.
4.Gibson P, Tong Y, Robinson G, Thompson MC, Currle DS, Eden C, Kranenburg TA, Hogg T, Poppleton H, Martin J et al: Subtypes of medulloblastoma have distinct developmental origins. Nature 2010, 468(7327):1095-1099.
5.Smith KS, Bihannic L, Gudenas BL, Haldipur P, Tao R, Gao Q, Li Y, Aldinger KA, Iskusnykh IY, Chizhikov VV et al: Unified rhombic lip origins of group 3 and group 4 medulloblastoma. Nature 2022.
6.Hendrikse LD, Haldipur P, Saulnier O, Millman J, Sjoboen AH, Erickson AW, Ong W, Gordon V, Coudière-Morrison L, Mercier AL et al: Failure of human rhombic lip differentiation underlies medulloblastoma formation. Nature 2022.
7.Lin CY, Erkek S, Tong Y, Yin L, Federation AJ, Zapatka M, Haldipur P, Kawauchi D, Risch T, Warnatz HJ et al: Active medulloblastoma enhancers reveal subgroup-specific cellular origins. Nature 2016, 530(7588):57-62.
8.Tu S, Narendra V, Yamaji M, Vidal SE, Rojas LA, Wang X, Kim SY, Garcia BA, Tuschl T, Stadtfeld M et al: Co-repressor CBFA2T2 regulates pluripotency and germline development. Nature 2016, 534(7607):387-390.
责任编辑丨BioTalker




















