在多种妇科肿瘤中,卵巢癌(OvCa)的死亡率高居首位,且大多数患者在诊断时已存在腹膜转移[1]。因为卵巢直接暴露于腹腔,与其他易于转移到实体器官(如肺和肝)的肿瘤不同,OvCa很少通过血液转移,而更容易发生腹膜转移[2]。
OvCa可以在腹膜、网膜、肠系膜等广泛转移,手术难以完全清除肿瘤,治疗效果较差。目前临床主要依靠顺铂、紫杉醇等化疗药物实现完全缓解。尽管近年来靶向药物的研发延长了患者的无进展生存期,但这些药物在延长总生存期方面作用仍然有限[3-4],对于OvCa的腹膜转移,仍然缺乏有效的治疗方法。
近日,来自名古屋大学的研究团队在Matrix Biology发表重要研究,他们发现,维生素D可以促进THBS1表达正常化,抑制间皮细胞间充质转化,并逆转肿瘤相关间皮细胞的间充质状态,从而抑制OvCa的腹膜转移[5]。

文章封面
有研究认为,控制腹膜转移可能在改善OvCa的难治性方面发挥重要作用。OvCa细胞从原发部位脱落后,经腹水携带至腹膜壁、肠系膜和大网膜等。正常情况下,这些部位被间皮细胞(MCs)覆盖,保护内脏免受病原体和肿瘤细胞的伤害[6]。许多研究表明,在肿瘤微环境中MCs具有促癌作用。
癌症相关的成纤维细胞(CAFs)是肿瘤基质中数量最多的细胞,可以产生各种促进肿瘤细胞生长的因子。在之前的研究中,研究团队证实了腹膜转移的OvCa基质中存在许多MC来源CAFs[7]。
在腹膜转移过程中,肿瘤细胞分泌的TGF-β1诱导上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程的发生,MCs转化为间充质状态。EMT诱导的MCs被称为肿瘤相关间皮细胞(CAMs),是促进OvCa进展的肿瘤微环境中重要的组成部分。结合既往研究结果,研究团队认为抑制CAMs的活性可能有助于OvCa的治疗。
有研究表明,维生素D不仅可以在维持钙稳态和调节骨代谢中发挥关键作用,还可以抑制细胞周期、增殖和血管生成等[8]。此外,已证实维生素D受体(VDR)的过表达与各种癌的良好预后相关[9]。
因此,研究团队推测,维生素D可以通过抑制MCs的EMT发挥抗肿瘤作用,从而治疗腹膜转移。

机制图
首先,研究团队对MCs的特异性标志物calretinin进行免疫组化(IHC),以确定MCs在大网膜转移的定位。结果显示,腹膜表面、肿瘤细胞浸润大网膜的区域都存在MCs,而OvCa原发部位未观察到MCs。研究团队接着检测了MCs和CAMs中VDR的表达,发现大网膜表面排列的MCs呈VDR阳性,网膜转移瘤的间质中也存在许多VDR阳性的MCs。多重免疫组化进一步验证了这一结论。

OvCa腹膜转移中可见来自MCs的VDR阳性成纤维细胞
研究团队还分析了公共数据库中的数据,发现VDR表达水平是OvCa一个重要的预后因素。在所有分期和III期OvCa患者中,VDR高表达的患者死亡风险降低25%(P=0.0013,P= 0.0056)。此外,VDR在基质细胞中的表达高于肿瘤细胞。这些结果表明,VDR在间质(包括MCs)的高表达与OvCa患者更好的预后相关。
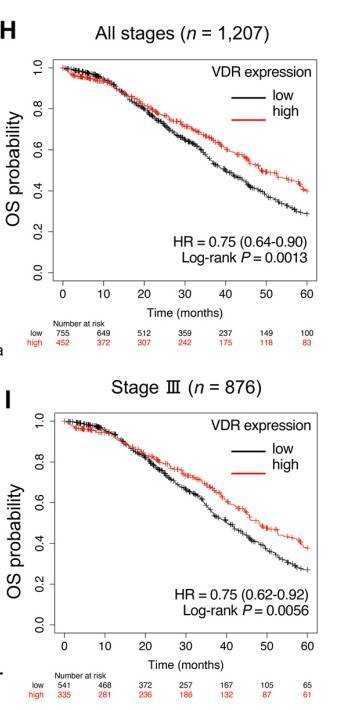
VDR高表达与OvCa患者更好的预后相关
前期研究已经证明OvCa的恶性腹水诱导了MCs的EMT,而TGF-β1是MCs中EMT的主要诱导因子。研究团队探索了TGF-β1存在时维生素D对MCs的影响。结果表明维生素D可以纠正TGF-β1刺激导致的MCs形态改变、E-cadherin表达水平降低、aSMA表达水平升高等。维生素D还可以减轻TGF-β1刺激诱导的EMT标志物水平的增加,如N-cadherin、MMP2、MMP9和Slug等。这些数据表明,维生素D通过改变EMT标志物的形态和表达,减弱TGF-β1诱导的MCs EMT。
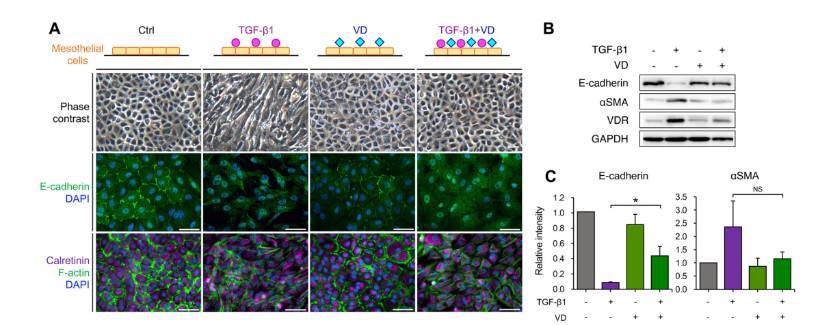
维生素D抑制TGF-β1诱导的上皮-间充质转化
接下来,研究团队对不同处理组的MCs进行RNA测序并进行分析,发现维生素D干预下调了EMT和局灶性粘连相关基因的表达。其中血栓反应蛋白-1(thrombospondin-1,THBS1)的表达在TGF-β1刺激的MCs中高度上调(27.90倍),并且在维生素D干预后下调最明显。qRT-PCR验证THBS1表达的变化后,研究团队分析了THBS1在OvCa患者中的表达。公共数据库的数据表明,THBS1高表达是不良预后因素(HR,1.35;P=0.0018)。

维生素D可下调促进粘附的关键蛋白THBS1的表达
因此研究团队推测,MCs中THBS1表达的增加可能促进OvCa细胞在腹膜的粘附,维生素D通过抑制THBS1的表达抑制MCs粘附。为了验证这一假设,团队进一步研究了维生素D对OvCa细胞粘附于MCs的影响。
实验结果显示,TGF-β1刺激的MCs中THBS1表达显著上调(79倍,P<0.0001),而添加维生素D会显著抑制THBS1的表达。此外,维生素D以浓度依赖的方式抑制OvCa细胞的粘附和增殖,THBS1以浓度依赖的方式增强OvCa细胞的粘附。
接下来,研究团队研究了维生素D介导的THBS1抑制的分子机制。既往研究已经证明,TGF-β信号通过配体与细胞表面表达的TGF-β受体复合物结合启动,然后通过磷酸化激活Smad2和Smad3,激活的Smad2/3与Smad4形成复合物,并通过与DNA结合作为转录因子来调控靶基因的表达。维生素D可通过VDR抑制Smad3的磷酸化。
本研究表明,VDR与Smad3竞争结合到THBS1的启动子区,抑制THBS1的转录。因此,维生素D通过抑制Smad3与DNA的结合抑制THBS1在MCs中的表达,从而抑制OvCa细胞与MCs的粘附。

维生素D通过VDR/Smad3竞争抑制THBS1抑制OvCa细胞粘附和增殖
研究团队还发现,维生素D处理后,MCs恢复上皮样状态,MCs中E-cadherin水平升高,actin应激纤维和THBS1的表达降低。在间充质状态下,MET不能自发或独立地诱导到上皮样状态,实验结果表明维生素D可以部分逆转稳定的MCs间充质状态。即使在肿瘤细胞存在的情况下,维生素D也能诱导处于间充质状态的MCs中MET,并使THBS1表达正常化。

维生素D可恢复TGF-β1诱导的MCs EMT和THBS1表达
最后研究团队在小鼠模型中验证了这些结果。体内实验表明,维生素D干预的小鼠腹膜表面THBS1表达水平、缺陷微绒毛面积、OvCa细胞腹腔播散率均低于单独TGF-β1处理的小鼠。蛋白免疫印迹和免疫荧光分析显示,维生素D处理后,随着MET诱导,腹膜表面THBS1表达恢复。

维生素D在体内可保护腹膜微绒毛,减少腹膜播散
总而言之,本研究强调了MCs是OvCa腹腔转移的关键决定因素,发现维生素D通过抑制TGF-β1诱导的MCs间充质状态来抑制肿瘤的发生,并确定THBS1是增强OvCa细胞粘附和增殖的关键蛋白。在体内,维生素D通过VDR/Smad3竞争抑制Smad依赖的TGF-β信号,从而抑制腹膜播散。
这一发现有希望作为临床治疗的补充,改善晚期OvCa患者的预后。

参考文献
[1] Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021 [published correction appears in CA Cancer J Clin. 2021 Jul;71(4):359]. CA Cancer J Clin. 2021;71(1):7-33. doi:10.3322/caac.21654
[2] Lengyel E. Ovarian cancer development and metastasis. Am J Pathol. 2010;177(3):1053-1064. doi:10.2353/ajpath.2010.100105
[3] Oza AM, Cook AD, Pfisterer J, et al. Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial. Lancet Oncol. 2015;16(8):928-936. doi:10.1016/S1470-2045(15)00086-8
[4] González-Martín A, Pothuri B, Vergote I, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019;381(25):2391-2402. doi:10.1056/NEJMoa1910962
[5] Kitami K, Yoshihara M, Tamauchi S, et al. Peritoneal restoration by repurposing vitamin D inhibits ovarian cancer dissemination via blockade of the TGF-β1/thrombospondin-1 axis. Matrix Biol. 2022;109:70-90. doi:10.1016/j.matbio.2022.03.003
[6] Mutsaers SE. The mesothelial cell. Int J Biochem Cell Biol. 2004;36(1):9-16. doi:10.1016/s1357-2725(03)00242-5
[7] Kenny HA, Chiang CY, White EA, et al. Mesothelial cells promote early ovarian cancer metastasis through fibronectin secretion. J Clin Invest. 2014;124(10):4614-4628. doi:10.1172/JCI74778
[8] Feldman D, Krishnan AV, Swami S, Giovannucci E, Feldman BJ. The role of vitamin D in reducing cancer risk and progression. Nat Rev Cancer. 2014;14(5):342-357. doi:10.1038/nrc3691
[9] Ferrer-Mayorga G, Gómez-López G, Barbáchano A, et al. Vitamin D receptor expression and associated gene signature in tumour stromal fibroblasts predict clinical outcome in colorectal cancer. Gut. 2017;66(8):1449-1462. doi:10.1136/gutjnl-2015-310977
责任编辑丨王雪宁