*仅供医学专业人士阅读参考
聚焦CAR-T制备、临床应用问题
嵌合抗原受体(CAR)T细胞疗法,简称CAR-T细胞疗法,是一种把人体T细胞体外经过基因改造,表达针对特定癌细胞进行攻击的嵌合抗原受体,回输体内后实现个性化抗肿瘤的疗法,目前主要用于治疗复发性血液肿瘤,实体瘤的CAR-T细胞疗法仍然在临床探索中。
CAR-T细胞疗法研究现状
CAR-T细胞疗法有两类,自体CAR-T来源于患者自体的T细胞,同种异体CAR-T来源于健康供体T细胞。以2017年Kymriah(Tisagenlecleucel)和Yescarta(axicabtagene ciloleucel)两种靶向CD-19的自体CAR-T细胞疗法在美国获批为开端,CAR-T进入快车道发展。
根据2021年的文献统计,全球正在研发中的CAR-T疗法有1164种。80%的CAR-T研发处于临床前和临床I期状态(见图一),开发中的自体CAR-T数量是同种异体CAR-T的两倍,不过进入II期临床的同种异体CAR-T在逐渐增多[1]。
血液肿瘤CAR-T的靶点主要是CD19、BCMA和CD22,实体瘤CAR-T的靶点除了HER2、EGFR等常见突变,也专注于某些癌症特异性的高表达靶点,如肝癌的磷脂酰肌醇蛋白多-2和磷脂酰肌醇蛋白多糖-3(GPC2/GPC3)等(见图二)。
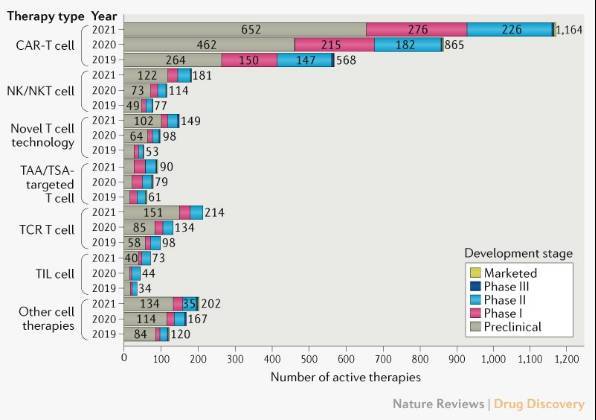
图一
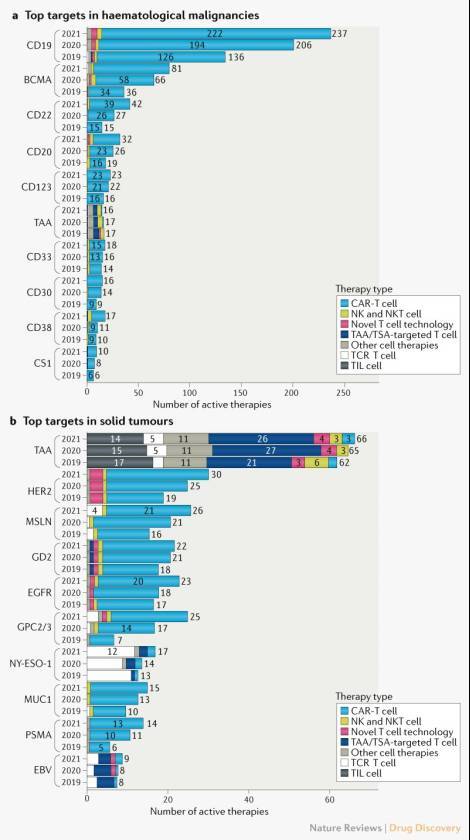
图二
CAR-T全球研发现状(可滑动查看)
目前CAR-T的研究趋势主要聚焦在两方面:
一方面开发新技术,推出自体CAR-T的快速制备平台;
另一方面利用锌指核酸酶(ZFN)、转录激活因子样效应核酸酶(TALEN)和CRISPR/Cas9等基因编辑技术,敲除供体细胞中的TCRαβ表达,改善人类白细胞抗原(HLA)介导的同种异体CAR-T移植物抗宿主病(GVHD)等副作用,推出同等疗效,价格更经济,供应时间更快捷,质控更稳定的同种异体CAR-T。
从长远讲,CAR-T研究的第三个焦点是实体瘤,抢得实体瘤CAR-T先机者,可得CAR-T产业大半壁江山。
CAR-T的全球研发是中美两强占统治地位,美国研发数占全球总量的38%,中国研发数占全球总量的34%,但是近年中国的研发增长逐年小幅领先于美国。两者的区别是美国主要由制药业承担大多数的研发工作,大学和医院处于辅助地位,而中国的研发是制药业和大学及医院对半开。
CAR-T细胞疗法
面临的问题
需要数据证明CAR-T的长期疗效和安全性。自体CAR-T制备贵而慢,对病人的细胞质量有依赖性。同种异体CAR-T易发生GVHD,易复发。无论自体还是同种异体,获批都是在三线以至末线疗法,急待数据支持升线。CAR-T获批病种局限于部分血液病,需技术革新扩展适应症。
本文根据2022年第27届欧洲血液学年会EHA的报告,谈谈业界在解决CAR-T细胞疗法面临问题上的努力和成绩[2]。
2022 EHA 高亮:CAR-T的长期疗效和安全性
ELIANA 临床试验数据
2022 EHA上更新的ELIANA和ZUMA-3临床试验数据证明了CD19靶向的CAR-T在急性淋巴细胞白血病(ALL)患者中的持久疗效和长期可控的安全性。
Rives等公布ELIANA临床试验最终数据分析结果(摘要号S112),对64位使用Kymriah治疗的复发性/难治性急性B淋巴细胞白血病(R/R B-ALL)患者,进行了超过5年的随访。患者在接受Kymriah前进行了中位为3线(1-8)的重度治疗,61%的患者有过干细胞移植(SCT)。
患者ORR为82%(95%CI,72%-90%),在完全缓解或不完全血液学恢复的完全缓解(CR/CRi)的患者中,5年无复发生存期(RFS)为49%(95%CI,34%-62%),随访时间46.8个月仍未达到中位RFS(n=15),数据令人印象深刻。
在长期随访期间,患者没有报告新的不良事件(AE)。缓解1年以上的患者中,发生的3级以上AE主要为感染(20%)和全血细胞减少(6%)。10位(14%)缓解期患者出现持续超过1年的全血细胞减少。
ZUMA-3临床试验数据
美国食品药品监督管理局(FDA)已批准CAR-T细胞疗法Tecartus(brexucabtagene autoleucel,曾用名KTE-X19)用于治疗复发/难治性套细胞淋巴瘤(R/R MCL)成人患者。目前Tecartus用于治疗R/R B-ALL成人患者正在I/II期ZUMA-3研究中进行评估。
Shah等在2022EHA上更新了Tecartus的ZUMA-3临床试验数据(摘要号P356),在中位随访时间26.8个月(20.7-32.6)后,接受过1或≥2线治疗的患者的总体CR/CRi率(95%CI)为90%(55%-100%)和67%(51%-80%)。在接受过1或≥2线治疗的患者中,缓解的中位(95%CI)持续时间(DOR)为4.7个月[1.8-不可估计(NE)]和14.6个月(9.4-NE),中位总生存期(OS)分别为NR(未达到)(2.1-NE)和25.4个月(14.2-NE)。
既往接受过1线或≥2线治疗的患者,发生≥3级细胞因子释放综合征(CRS)为10%和27%。发生≥3级神经系统AE分别为30%和24%。
这两项研究证明了Kymriah和Tecartus在R/R B-ALL患者的持久疗效和长期安全性,为适应症扩展和今后的CAR-T临床开发提供了数据支持。
2022 EHA高亮:CAR-T有望升级为NHL二线治疗
既往为了探索CAR-T是否能作为非霍奇金淋巴瘤NHL的二线治疗方案,发起了ZUMA-7,TRANSFORM和BELINDA三个临床试验来比对验证CAR-T和二线标准疗法的差异。ZUMA-7和TRANSFORM的积极结果,BELINDA的无差异结果提示我们,将来对于有适应症的患者才能选择CAR-T作为NHL二线治疗。
Locke等在2022EHA上更新了Tecartus的ZUMA-7临床试验数据(摘要号P1198),对于复发/难治性大B细胞淋巴瘤(R/R LBCL)在所有亚组分析中,Tecartus均优于二线标准疗法。对于治疗前肿瘤负荷高或低的患者,Tecartus组的无事件生存率EFS均优于二线标准疗法(HR,0.29和0.49;P
对于治疗前肿瘤负荷高的患者,和组织缺氧相关乳酸脱氢酶较高的患者,Tecartus比二线标准疗法更具优势,根据既往ZUMA-7的数据分析,Tecartus有望获批用于之前未进行桥接化疗R/R LBCL患者的二线治疗。
自体CAR-T的快速制备平台:
不可忽视的中国力量
尽管CAR-T由自体CAR-T细胞疗法研究起步,并率先取得了临床突破,但自体CAR-T细胞疗法有两个主要短板,首先是制备过程复杂漫长,一般需2-4周的体外制备扩增才能回输给患者,在需要的时候不能做到“召之即来、来之能战”。其次是自体T细胞的质量和数量,受限于多线放化疗治疗后患者虚弱的免疫系统,无法做到100%的制备成功。
自体CAR-T的研发者在竞争中要取得对同种异体CAR-T的优势,首先要尽量缩短制备时间的改进平台,其次要有提高制备成功率的独门绝学,以抢得先机。
中国FasTCAR平台产品:治疗复发/难治性多发性骨髓瘤(R/R MM)
上海亘喜生物,拥有自体CAR-T快速制备平台FasTCAR,能将自体生产时间从行业标准的2到6周,显著缩短到次日生产完毕[3]。几乎将自体CAR-T细胞和同种异体CAR-T(预制,冷冻保存)的可用时间拉到同一个时间点上,在保证细胞质量的前提下,又具有无GVHD的优势,非常具有竞争性。
GC012F是亘喜FasTCAR快速制备平台制造的BCMA和CD19双靶向CAR-T,选择双靶以克服治疗中存在的抗原逃逸和复发等问题,GC012F制造时间显著缩短为22-36小时,临床用于治疗R/R MM患者。
在2022 EHA上,亘喜的自体CAR-T GC012F继ASCO和2021EHA的报告后,又新增了9位患者数据(摘要号S186)。从2019年10月到2021年11月,28名经过蛋白酶体抑制剂、免疫调节药物和CD38抗体等多线治疗(中位数为5,范围2-9)的R/R MM患者(年龄27-76岁)参加了单臂、开放标签、多中心临床试验。其中89.3%的患者(25/28)按照mSMART危险分层为高危(HR-mSMART)。
GC012F分为3个剂量组单次输注给药:1x105/kg(DL1组,n=2)、2x105/kg(DL2组,n=10)和3x105/kg(DL3组,n=16)。到2022年1月26日,对28位患者进行了中位随访6.3个月(1.8-29.9)的随访评估。DL1组中的客观缓解率(ORR)为100%(2/2),DL2组ORR为80%(8/10),DL3组ORR为93.8%(15/16),除有1位无法接受评估,其余27位患者微小残留病变MRD均为100%阴性。
GC012F的治疗相关AE也在可控范围,大多数患者细胞因子释放综合征(CRS)为低级别,0级3例(10.7%),1-2级23例(82.1%),3级2例(7.1%),未观察到4/5级CRS,也未观察到免疫效应细胞相关神经毒性综合征(ICANS),中位CRS的持续时间为3天(1-8天)。截止到6月8号EHA大会前,患者的中位缓解持续时间(mDOR)为15.7个月(95%CI:7.6-33.1),DOR仍在继续观察中。
根据目前的数据,多剂量GC012F治疗R/R MM患者后监测MRD阴性率高,安全性良好,副作用可控,验证了FasTCAR平台的先进性、有效性和可靠性,也为GC012F走向R/R MM的一线治疗打下基础。
中国FasTCAR平台产品:治疗复发/难治性B细胞非霍奇金淋巴瘤(R/RB-NHL)
在体外NOG小鼠荷瘤模型中,GC012F可以抑制B细胞淋巴瘤,套细胞淋巴瘤和伯基特淋巴瘤的生长。在2022 EHA上,亘喜生物把R/R B-NHL作为GC012F的潜在适应症,首次展示由研究者申请发起GC012F治疗R/R B-NHL的I期临床试验数据(摘要号P1218)。
截至2022年2月22日数据显示,3位中位年龄为52岁(31-60)的IV期复发/难治性弥漫大B细胞淋巴瘤(R/R DLBCL)患者,之前接受过中位数为2线(2-3)的治疗方案并快速进展,各自接受了一次GC012F输注,剂量分别为3.7×104CART/kg和2-3×105CAR-T/kg。
给药后1个月随访,3位患者都获得CR,CR率100%。GC012F在三种不同剂量下显示了初步安全性和耐受性。2名患者发生1级CRS,输注剂量3×105CAR-T/kg的患者发生3级CRS,3位患者都没有ICNS。
GC012F治疗R/R B-NHL的初步结果比较乐观,仍需要通过更多I期试验病例来推荐II期剂量。
诺华T-Charge平台产品:治疗R/R DLBCL
T-Charge是诺华的下一代CAR-T快速制备平台,T-Charge平台可以在2天内完成CAR-T细胞的制备,然后输注进患者体内进行T细胞扩增。T-Charge平台主要产品有靶向CD19的自体CAR-T产品YTB323,用于治疗R/R DLBCL。靶向BCMA的自体CAR-T产品PHE885,用于治疗R/R MM[4]。
诺华在2021ASH上公布了I期临床试验的初步数据。接受第2组DL2剂量YTB323治疗的15例DLBCL患者,第3个月CR率达到了73%。接受最高剂量PHE885治疗的11例R/R MM患者,ORR达到100%。
在2022 EHA上,诺华更新了YTB323(摘要号S212)数据,R/R DLBCL患者接受YTB323单次给药,第1组DL1剂量为2.5×106,第2组DL2为12.5×106,第3组DL3为25×106,第4组DL4为40×106个CAR-T细胞。
DL1组治疗的患者,中位随访时间为20个月,ORR和CR率均为75%。DL2组治疗的患者,中位随访时间为7个月,ORR和CR率分别为81%和75%。
在进行YTB323安全性评估的20名患者中,每人都经历了至少1起治疗相关AE。80%的患者至少1个AE级别≥3。DL1组1例患者(25%)出现1级CRS。DL2组5例患者(31%)出现CRS,包括4例(25%)1-2级CRS,1例(6%)4级CRS。5例患者(25%)出现1级神经系统不良事件(NE)。最终有5例患者在输注30天后死亡。
诺华T-Charge平台产品:治疗R/R MM
PHE885的更新中(摘要号P1446),患者的剂量分组为2.5×106(n=4),5×106(n=12),10×106(n=5),和14.3×106(n=1)个CAR-T细胞输注。有15例患者(2.5×1064例,5×10610例,14.3×1061例)进行了安全性和有效性评估。患者的ORR为93%,CR率为33%,非常好的部分缓解(VGPR)率为20%,部分缓解(PR)率为40%。
3例患者出现剂量限制性毒性(DLTs),包括1例无症状3级转氨酶升高(n=1,14.3×106),1例无症状≥3级的胰酶升高(n=1,5×106)和1例4级中性粒细胞减少症(n=1,2.5×106)。最常见的3级以上AE包括中性粒细胞减少症(n=15,100%)、贫血(n=13,87%)和血小板减少(n=11,73%)。所有患者均出现CRS,2例出现≥3级CRS。4例患者(27%)出现2级神经系统毒性。
同时PHE885(摘要号PB1983)也公布II期临床试验入组招募的基本情况。
比对2022EHA上两个自体快速制备平台,直观上FasTCAR的产品安全性略优于T-Charge,目前为止FasTCAR产品的AE的比例小,3级以上严重AE少,无患者死亡。但目前的样本数不足,我们仍需要后续数据观察疗效和安全性。
同种异体CAR-T:群雄并起
同种异体CAR-T能不能压倒自体,成为游戏规则的改变者,要看疗效和安全性,要看基因编辑的技术好不好,把GVHD的影响降到接近于无。同种异体CAR-T生产的兴起,也会促进白细胞采集等上下游行业的兴隆。
中国TruUCAR平台产品:治疗R/R B-ALL
GC502是亘喜生物同种异体CAR-T制备平台TruUCAR利用CRISPR/Cas9基因编辑技术制备的CD19/CD7双靶CAR-T产品。Li等在2022EHA上更新了GC502治疗R/R B-ALL患者I期临床试验的早期结果,以评估GC502安全性和初步疗效(摘要号P370)。在4位可评估反应的患者中,有3位患者达到了CR/CRi;1名EM患者在治疗1个月后获得PR,在第39天接受了异体移植。
AE方面,3级发热性中性粒细胞减少症(4/4)、4级血小板减少症(1/4)和3级贫血(3/4)。所有AE用标准方案处理后解决。非血液学的AE表现为3级及以上γ-GT增加(3/4),3级及以下AST增加(2/4)和3级及以下ALT增加(3/4)。2名患者出现3级CRS,持续时间分别为7天和10天。2名患者出现2级CRS使用配方B,疗程分别为9天和15天。
美国CRISPR Therapeutics产品:治疗复发/难治性 T 细胞淋巴瘤(R/R TCL)
美国基因编辑公司CRISPR Therapeutics的同种异体CAR-T细胞疗法CTX130,靶向癌细胞上的CD70,CRISPR Therapeutics利用CRISPR/Cas9基因编辑技术,对来源于健康供体的T细胞进行3次基因编辑,目前用于R/R TCL患者的临床试验。
Iyer等I期临床试验研究中(摘要号S262),评估了CTX130在17名R/R TCL患者中的安全性和有效性。在两个最高剂量水平下,7名患者的ORR为71%,包括2位CR(29%)。在外周TCL(PTCL)和皮肤TCL(CTCL)的患者中都观察到了反应。接受CTX130治疗的7位患者没有发生GVHD,没有3级或更高级别的CRS或免疫效应细胞相关的神经毒性综合征。
早期结果表明CTX130是安全有效的,可为R/R TCL患者提供具有临床获益。
美国Caribou Biosciences产品:治疗R/R B-NHL
Caribou Biosciences的CB-010,是一种具有PD-1敲除、同种异体靶向CD19的CAR-T细胞疗法,在2022EHA上Nastoupil等首次公布了CB-010的ANTLER I期临床试验的疗效数据(摘要号P1455)。
共治疗6位R/R B-NHL患者(DLBCL:2,PMBCL:1,FL:2,MCL:1),5位可评估的患者ORR为100%,4位CR。中位随访4.5个月(0.6-8.6),3位患者继续缓解,其中1位已超过8个月,但另1位在6个月后复发。
治疗相关的AE方面,1位患者同时出现1级CRS和3级ICNS。6位患者中有3位在前28天内出现3级或4级AE:中性粒细胞减少症(50%),血小板减少症(33%)、贫血(16.7%)和低丙种球蛋白血症(16.7%)。
CB-010做了一些技术性尝试,敲除了TRAC基因和PD-1基因,通过去除T细胞受体以避免移植物抗宿主病,并限制T细胞衰竭来增加长期疗效,避免治疗后复发。目前的初步数据证明了CB-010在R/R B-NHL患者中有望获得安全性和有效性,后续效果有待观察。
其它:
限于篇幅,其它部分较有前景的新进展或新产品,如CARTITUDE-1/CARTITUDE-2临床试验,欧洲新CAR-T ARI0002h的疗效,UCART19的进展,我国CS1(SLAMF7)-BCMA双靶点CAR-T等,就不一一介绍。
结语:
CAR-T细胞疗法的研究将持续在有效性、安全性、便捷性和扩展性等发展方向发力。尽可能提高治疗反应率以至治愈率。有效控制治疗相关AE的发生。改进自体CAR-T细胞疗法制备周期时长,提高制备成功率。将CAR-T细胞疗法继续开疆扩土,从血液肿瘤向实体瘤治疗扩展。
参考文献:
[1]Upadhaya S,et al.The clinical pipeline for cancer cell therapies.Nat Rev Drug Discov.2021 Jul;20(7):503-504.doi:10.1038/d41573-021-00100-z.PMID:34088999.[2]https://journals.lww.com/hemasphere/Documents/EHA2022%20Congress%20Abstract%20Book.pdf
[3]https://cn.gracellbio.com/fastcar/
[4]https://www.novartis.com/news/media-releases/novartis-announces-t-chargetm-next-generation-car-t-platform-first-human-data-ash-2021
你想要的前沿资讯
敬请关注医生站